新药研发是一项融合了尖端科学、严谨工程与巨大商业冒险的系统性工程。从最初的灵光一现到最终惠及患者,其历程往往跨越数十年,耗资数十亿美元,成功率却微乎其微。这个过程不仅是科学与技术的长征,更是对人类耐心、智慧与资源的终极考验。
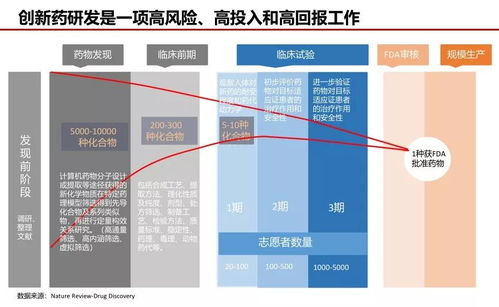
第一阶段:药物发现与临床前研究(约3-6年)
一切始于一个“靶点”——即与疾病相关的生物分子(如蛋白质、基因)。科学家通过基因组学、蛋白质组学等研究,识别出可能导致疾病的靶点。在数以万计乃至百万计的化合物库中,通过高通量筛选、计算机辅助药物设计等手段,寻找能够与靶点相互作用并调节其功能的“先导化合物”。
获得先导化合物后,便进入复杂的优化阶段。药物化学家对其进行反复的结构修饰与改造,旨在提升其效力、选择性(只作用于靶点,减少副作用),并改善其“类药性”,即药物在人体内吸收、分布、代谢、排泄(ADME)的特性。毒理学家开始在细胞模型和动物模型(如小鼠、大鼠、犬类)中进行全面的药效学、药代动力学和安全性评估。这一阶段的核心目标是得到一个在有效性和初步安全性上都表现优异的候选药物,并为其申请进入人体临床试验。
第二阶段:临床试验(约6-7年)
这是新药研发中耗时最长、成本最高、风险最集中的环节,分为三期:
- I期临床试验:通常在少数(20-100名)健康志愿者或患者中进行。主要目的是评估药物的安全性、耐受性,并初步了解其在人体内的代谢过程和药理活性。此阶段确定药物的安全剂量范围。
- II期临床试验:在数百名目标疾病患者中进行。重点在于评估药物的有效性(是否对疾病有治疗作用),并进一步观察其安全性,为III期试验的设计(如剂量、给药方案)提供依据。此阶段淘汰率极高。
- III期临床试验:在更大规模(数百至数千名)的患者群体中进行,采用随机、双盲、对照的严谨设计。这是确证性试验,旨在全面评估药物的有效性和安全性,充分了解其益处与风险比。成功通过III期试验,是药物获批上市的关键基石。
第三阶段:监管审批与上市(约1-2年)
完成所有临床试验后,研发企业需向监管机构(如美国FDA、中国NMPA)提交浩如烟海的申报资料,包括所有药学、临床前和临床试验数据。监管机构进行极其严格的审评,评估药物的效益是否大于风险。这个过程可能要求企业补充数据或进行更多研究。最终获批后,新药方可正式上市销售。
第四阶段:上市后监测(IV期临床试验)
新药上市并非终点。在真实世界的广泛应用中,药品需要在更大、更多样化的人群中接受长期的安全性监测,以发现那些在前期临床试验中因样本量有限而未能发现的罕见或长期不良反应。这是对患者安全持续负责的重要环节。
贯穿始终的挑战与感叹
纵观全流程,新药研发的“高风险”属性无处不在:靶点验证可能失败,化合物可能无效或毒性太大,任何一期临床试验的负面结果都可能导致前功尽弃。统计显示,平均每5000-10000个初始化合物中,最终只有一个能成功上市。其“高投入”同样惊人,根据塔夫茨大学药物开发研究中心的评估,成功研发一个新药的平均成本已超过26亿美元。
这数十年、数十亿的“大工程”,汇聚了生物学、化学、医学、统计学、数据科学、工程学等多学科顶尖人才的智慧与汗水。每一次成功上市的创新药背后,都意味着对生命奥秘的又一次深刻理解,以及对人类健康福祉的一份坚实贡献。在感叹其艰辛与昂贵之余,我们更应对这份致力于攻克疾病、延长生命、提高生活质量的伟大事业,报以最高的敬意与期待。